檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox
檢測到您當前使用浏覽器版本過于老舊,會導緻無法正常浏覽網站;請您使用電腦裡的其他浏覽器如:360、QQ、搜狗浏覽器的極速模式浏覽,或者使用谷歌、火狐等浏覽器。
 下載Firefox
下載Firefox
RNA堿基編輯作為一項全新的疾病治療策略,越來越受到廣泛關注。ADAR作為一種細胞内源的RNA脫氨酶已經被廣泛應用于RNA堿基編輯。基于ADAR的RNA編輯利用了細胞翻譯機制的一個獨特性質,即由于結構相似性,肌苷會被識别為鳥嘌呤。這使得ADAR編輯器能夠引入特定位點的、由RNA引導的腺嘌呤到肌苷(A-to-I)的改變,從而打開了廣泛的治療潛力,包括修正緻病突變、調節基因表達或改變蛋白質相互作用等[1]。2019年魏文勝課題組開發了LEAPER技術(Leveraging Endogenous ADAR for Programmable Editing of RNA) [2],并于2022年升級為LEAPER 2.0 [3],通過工程化的環狀RNA招募細胞内源的ADAR蛋白,在靶向位點實現了高效且精準的編輯。由于LEAPER是一種依賴于内源ADAR活性的編輯系統,而不同組織和物種中内源 ADAR 的表達存在差異,并且遞送方法尚未得到全面驗證,因此該技術仍需在多個物種,特别是非人靈長類中進行測試。在這項研究中,研究人員進一步利用AAV将工程化的環狀ADAR招募RNA(circ-arRNA)遞送到非人靈長類動物及人源化小鼠體内,以實現長期、高效和精準的RNA堿基編輯。
首先,研究人員在非人靈長類動物的體外培養細胞内進行了實驗,通過優化獲得了高效且精準的工程化circ-arRNA,其靶向位點的編輯效率可高達47%。随後,他們将該工程化circ-arRNA包裝到AAV病毒中,成功實現了在非人靈長類動物體内的遞送。然而,臨床上使用的AAV劑量一旦超過1 × 1014 vg/kg,會帶來嚴重毒性[4],因此該研究将AAV劑量控制在臨床可接受的範圍内,分别為3×1012,1×1013和3×1013 vg/kg的劑量 (圖1A)。将這三種劑量的肝靶向AAV8注射到非人靈長類動物體内,并進行長期觀察和檢測,結果顯示在第二周,肝髒細胞編輯效率可達50%以上(圖1B)。通過計算感染效率(圖1C)發現受AAV感染的肝髒細胞編輯效率可高達80%,這表明LEAPER 2.0可以在體内快速且高效地發揮作用。此外,研究人員還發現,編輯效率呈劑量依賴性,随着AAV8劑量的升高,非人靈長類動物體内工程化circ-arRNA的表達量增加,從而提高了編輯效率,這表明LEAPER 2.0具有良好的藥物劑量依賴性 (圖1D)。編輯效率在非人靈長類動物體内可以維持13周并保持穩定,說明通過AAV遞送的LEAPER 2.0具有長期編輯的特點(圖1E)。此外,研究者未觀察到LEAPER 對非人靈長類動物具有毒性,表明該編輯技術是安全且特異的。

圖1. AAV遞送的LEAPER 2.0在非人靈長類動物體内實現高效、長時程編輯
進一步地,研究人員嘗試使用AAV遞送的LEAPER 2.0來治療人源化轉錄本中的提前終止密碼子。提前終止密碼子導緻了11%的人類遺傳病[5],因此針對此類密碼子的編輯具有巨大的應用前景。為此研究者構建了人源化的Hurler綜合征小鼠,該小鼠表達人源化的IDUA轉錄本,其中存在一個提前終止密碼子,導緻該小鼠可以模拟人類溶酶體貯積症,即粘多糖貯積症 I 型 (MPS-I)(圖2A)。 MPS-I的特征是α-L-艾杜糖苷酶的酶活性缺陷,導緻糖胺聚糖 (GAG)的積累。通過篩選和理性設計,研究者成功地提高了ADAR編輯的精确性,并獲得了高效的工程化circ-arRNA。使用AAV-PHP.eB遞送circ-arRNA到小鼠體内,不僅在肝髒等器官,而且在神經系統恢複了α-L-艾杜糖苷酶的酶活性(圖2B,C),降低了GAG的積累,顯著改善了小鼠的表型。由于目前MPS-I的治療策略多為酶替代療法,遞送的IDUA蛋白不能跨越血腦屏障,因此無法治療中樞神經系統中的GAG積累[6],而LEAPER 2.0介導的RNA編輯能夠在多個器官中恢複細胞内源IDUA轉錄本的功能,從而實現了更優的治療效果。
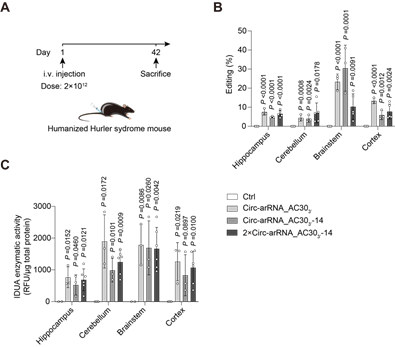
圖2. AAV遞送的LEAPER 2.0成功治療人源化Hurler綜合征小鼠
結合研究者在非人靈長類動物和人源化小鼠中的研究結果,LEAPER 2.0 為遺傳性疾病治療以及其他嚴重疾病的潛在臨床應用提供了巨大的希望。這些發現極大地加強了通過AAV遞送的工程化環狀ADAR招募RNA用于治療和探索性轉化研究的前景。這項研究由博雅輯因生物科技有限公司和北京大學魏文勝課題組合作完成。博雅輯因科學創始人,北京大學魏文勝教授和博雅輯因袁鵬飛博士為該研究的共同通訊作者。魏文勝課題組伊宗裔博士、博雅輯因趙豔霞博士、易澤軒博士和張永建博士為論文的共同第一作者,博雅輯因湯剛彬博士等人也對這項研究作出了重要貢獻。該研究項目得到了國家重點研發計劃、國家自然科學基金重點項目、北京市科委生物醫學前沿創新推進項目、北大-清華生命科學聯合中心、昌平實驗室和中國博士後科學基金的支持。
原文鍊接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-023-03086-6
參考文獻:
1. Sheridan C: Shoot the messenger: RNA editing is here. Nat Biotechnol 2023, 41(3):306-308.
2. Qu L, Yi Z, Zhu S, Wang C, Cao Z, Zhou Z, Yuan P, Yu Y, Tian F, Liu Z et al: Programmable RNA editing by recruiting endogenous ADAR using engineered RNAs. Nat Biotechnol 2019, 37(9):1059-1069.
3. Yi Z, Qu L, Tang H, Liu Z, Liu Y, Tian F, Wang C, Zhang X, Feng Z, Yu Y et al: Engineered circular ADAR-recruiting RNAs increase the efficiency and fidelity of RNA editing in vitro and in vivo. Nat Biotechnol 2022, 40(6):946-955.
4. Agarwal S: High-dose AAV gene therapy deaths. Nat Biotechnol 2020, 38(8):910.
5. Mort M, Ivanov D, Cooper DN, Chuzhanova NA: A meta-analysis of nonsense mutations causing human genetic disease. Hum Mutat 2008, 29(8):1037-1047.
6. Parini R, Deodato F: Intravenous Enzyme Replacement Therapy in Mucopolysaccharidoses: Clinical Effectiveness and Limitations. Int J Mol Sci 2020, 21(8).